의약품의 신뢰는 의약품 약효(품질)의 실뢰로 부터 정의될 수 있습니다. 의약품에 사용될 원자재 부터 최종 완제 의약품이 출하되는 과정에서 생성되는 모든 데이터 (수기기록 및 전자기록) 들은 생성된 그대로 (Original) 사용되고 폐기 전까지 그 상태(Integrity) 가 유지되도록 관리 되어야 합니다.
2020년 하반기에 식약처에서 ‘데이터 완전성 평가 지침’을 내놓으면서 국내 데이터 완전성의 중요성이 대두되었습니다만, 미국 및 유럽 여러 국가에서는 2015년 부터 중요성이 강조되기 시작했습니다.
데이터 완전성
데이터 완전성 이란 GMP 활동 및 의사결정에 사용되는 GMP 데이터(data = Paper data + Electronic data + 사진/차트 등 보조 자료 등) 가 데이터의 생애 주기 (Data Lifecycle = 생성 – 가공 – 보고 – 보관 – 폐기) 동안 완전하게 유지되기 위한 요구 사항(Requirement) 입니다.
1) FDA 의 데이터 완전성 정의
FDA DI Guidance (Data Integrity and Compliance With CGMP Guidance for Industry) 에 따르면,
이 지침의 목적 상 데이터 완전성은 데이터의 완전성(Completeness), 일관성(Consistency) 및 정확성(Accuracy)을 의미합니다.
완전(Complete)하고 일관(Consistent)되며 정확한(Accurate) 데이터는 귀속 가능(Attributable)하고 읽을 수 있으며(Legible) 동시에 기록(Contemporaneously)되고 원본(Original) 또는 실제 사본(True copy)이어야 하며 정확(Accurate)해야 합니다.
2) MHRA(영국 의약품 안전관리기구) 의 데이터 완전성 정의
데이터 완전성은 데이터가 완전(Complete)하고, 일관(Consistent)되고, 정확(Accurate)하고, 신뢰할 수 있고(Trustworthy), 믿을 수 있고(Reliable), 데이터의 이러한 특성이 데이터 수명 주기(Lifecycle) 동안 유지되는 정도입니다.
‘Data Integrity’ 는 식약처의 지침 상 용어로써 ‘데이터 완전성’ 으로 번역하고 있습니다. ‘데이터 무결성, 데이터 완결성’ 이라고 번역하더라도 의미가 다르지 않겠으나, 통일된 용어로 ‘데이터 완전성’으로 명시하고 있으며, 보통 필드에서는 ‘데이터 완전성’ 보다는 ‘데이터 인테그리티(Data Integrity)’ 라고 명칭하거나 간단히 ‘DI (디아이)’ 라고 사용하는 경우가 매우 흔합니다.
데이터 완전성 역사
데이터 완전성은 새롭게 만들어진 개념이나 규정이 아니라는 것을 이해해야 합니다. 왜냐하면, 데이터 완전성에 대한 관리 기준이나 관리 필요성에 대해 인식하지 못했던 것일 뿐이며, 오랜 과거에서 부터 제조 과정에서 기록되는 제조기록서 및 품질 시험 기록서와 품질 시험 결과지 들은 모두 데이터로써 사용되어 졌기 때문입니다.
서두에 언급한 바와 같이, FDA 에서는 2015년 전/후로 ‘데이터 완전성’ 관리 필요성을 인식했고, 특히 데이터의 임의 변조/조작/은폐 등의 행위들로 인해 데이터의 신뢰가 무너지고, 이는 의약품 품질에 대한 의심으로 이어지게 됩니다. 실제 FDA Warning Letter 중 데이터 완전성 위반으로 인한 Warning letter 의 수가 2015년-2016년 급격히 증가했음을 알 수 있습니다. 출처 – https://www.pharmaceuticalonline.com/doc/an-analysis-of-fda-warning-letters-on-data-integrity-0003
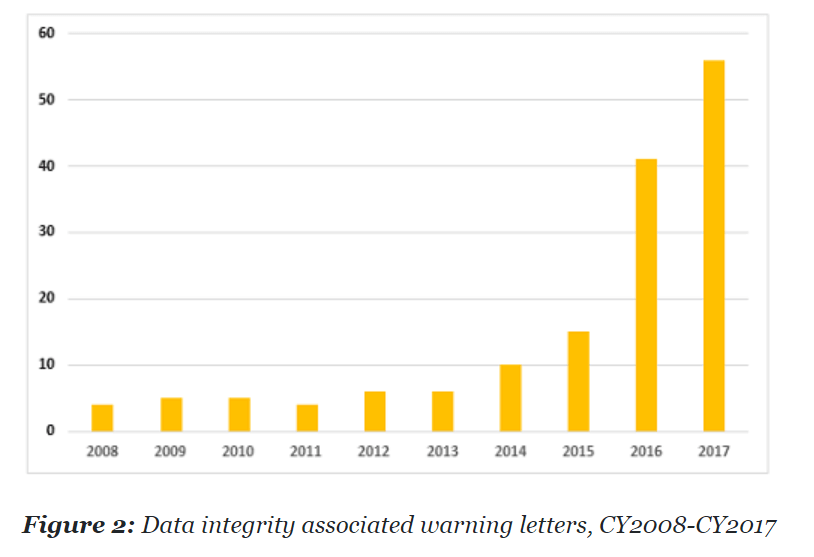
2015년 이후, 해외의 의약품 허가 규제 기관 (FDA, MHRA 를 비롯해) 들은 데이터 완전성(Data Integrity) 개념 및 관리 기준(Requirement) 을 담은 가이던스와 규정을 내놓기 시작했습니다. 하지만, 국내에서는 그 중요성이 심각하게 인식되진 않았습니다.
그러나 국내에도 데이터 완전성에 대한 관심과 일부 FDA 등 해외 규제 기관의 Inspection 을 받게되는 업체들을 통해 데이터 완전성의 중요성과 관리 필요성이 인식되기 시작했고, 식약처에서도 약사 감시 과정에서 데이터 완전성과 연관된 중대 지적 사항들이 하나씩 대두 되었습니다.
2021년 이후로 ‘B사’, ‘V사’, ‘CKD사’ 를 비롯해 가장 최근에는 ‘H사’ 가 첨가제 임의 사용 및 제조기록서 거짓작성 등으로 GMP 적합 판정 취소 이슈 까지 진행되고 있습니다.
주요 위반 사항들은 아래와 같았습니다.
▲ 2017년 1월경부터 2021.3.8.까지 5개 품목에 대해 변경관리절차서에 따른 변경관리 미실시 ▲ 의약품 제조 전 제품 청소 관련 기록을 기계·설비 세척 후 특정 시점에 특정인이 몰아서 작성 등 작성된 기준서 내용 미준수 ▲ 품목허가 사항 중 주성분 분량 변경, 제조방법, 주성분 외 원료 등을 임의로 바꾸었으나,변경허가(신고)를 득하지 않고 제조 판매 ▲주성분 분량 변경, 제조방법, 주성분 외 원료 등을 임의로 바꾸어 제조 및 판매했으나, 제조기록서는 허가사항과 같이 제조한 것처럼 작성
출처 : 팜뉴스(http://www.pharmnews.com)
△첨가제를 변경허가 받지 않고 임의 사용 △제조기록서 거짓 이중 작성 △제조방법 미변경 △원료 사용량 임의 증감
출처 : 히트뉴스(http://www.hitnews.co.kr)
데이터 완전성 향후 준비 과제
1) 데이터 완전성 Setup 문제
데이터 완전성 지침을 반영해 각 업체의 정책과 절차, 시스템에 대한 점검과 평가를 반영하고 있습니다. 그러나, 큰 그림을 그리지 못하고 산재되어 있는 여러가지 상황들을 처리하다보면 큰 맥락을 놓치고 두 번일을 하게 되는 경우가 발생합니다.
우선적으로는 회사의 현재 상태를 정확히 파악하고 (정책/시스템/문화 측면에서), 우선적으로 개선해야 할 것들을 Risk 기반하에 우선 순위를 정해야 합니다. 큰 맥락에서 점검 계획 및 조치 순서를 정하는 과정에서 필요한 인력과 비용을 효과적으로 설정할 수 있게 됩니다.
특히, 데이터 완전성을 정확히 이해하지 못한 상태에서 단순히 ‘자동화’ 를 위한 시스템 도입이 해결책이 된다는 생각으로 고가의 시스템을 적용하기 보다는 해당 시스템을 데이터 완전성 규정 내에서 control 할 수 있는 정책과 절차가 우선되어야 합니다.
데이터 완전성 문화 정착
앞서 데이터 완전성 규정을 반영한다는 명목으로 단순하게 ‘자동화’ 시스템을 도입하는 것에 대해 우려하는 점이 많다고 했습니다. 그 이유는 ‘자동화’ 시스템 또한 Setup 을 하는 ‘작업자/담당자’ 가 필요하며, setup 된 시스템을 관리/운영하는 ‘관리자’ 가 반드시 필요하기 때문입니다.
무균 제제 의약품 생산에서 오염 Risk 요인이 가장 큰 것은 무엇일까요? 바로 작업자 입니다. 데이터 완전성 정책/절차가 아무리 잘 setup 되었더라도 데이터완전성 위험에 가장 큰 영향을 미치는 것 또한 ‘작업자’ 입니다. ‘수기 기록’은 물론이고, 자동화 시스템과 작업자 사이의 상호작용(Interaction) 단계가 많아 질 수록 데이터 완전성 위험은 증가하게 됩니다.
데이터 완전성 정책을 만들고 시스템을 도입하는 것도 중요하지만, 그 근간에는 시스템을 setup 하고 사용하는 ‘작업자’ 의 데이터 완전성 인식(Data Integrity culture) 이 뿌리를 내려야 온전한 데이터 완전성 열매를 얻어 낼 수 있습니다.
데이터 완전성 정착의 어려움
전통적인 제조 기반 산업인 제약산업에서 데이터 완전성 규정은 비효율성, 비 효과적인 작업 능률의 끝판왕이 됩니다. 미뤄뒀던 기록 수행을 항상 실시간으로 기록 해야 하고, 기대하지 않은 사건/상황이 발생 했을 때 임의로 처리할 수 없게 됩니다.
이 경우, 제조 작업은 멈춰지게 되고, 계획했던 제품 생산량과 출고 일정에 영향을 미칩니다. 이는 곧 회사의 매출과 직결된 부분이기 때문에 제조/생산을 지연 시키는 대신, 첨가제를 더 넣거나, 허가 받지 않은 비율대로 임의 제조를 진행해 품질 기준에 맞춰 가까스로 출고를 시키는 결정을 하게 되는 악순환에 빠집니다.
이러한 상황에 과연 어떤 작업자/직원이 ‘데이터 완전성’ 위반상황이고, GMP 규정을 무시하는 것 아니냐고 얘기할 수 있을까요?
데이터 완전성 정착을 위한 품질 문화 (Quality Cultrue) 의 정착이 어려운 이유 입니다. 회사가 앞장서 GMP 규정 준수의 중요성을 우선시 해야만, 의약품의 제조의 신뢰 및 데이터 완전성 문화가 정착 기반이 만들어 집니다. 회사 및 상위 관리진 분들의 확고한 결정 없이는 아무리 데이터 완전성이 중요하고, 관련 교육을 직원들에게 강요하더라도 돌아오는 피드백은 부정적일 수 밖에 없음을 냉정하게 인식해야 합니다.
데이터 완전성의 정착은 정확한 진단과 개선 방향의 수립을 통해 시작하시길 바랍니다. 귀사의 현재 상황을 점검하고 수준에 맞는 개선 방향에 대한 가이드가 필요하시다면, 댓글 또는 아래 경로를 통해 연락 주시기 바랍니다.

